新闻动态
乳铁蛋白婴幼儿健康效应专家共识
发布时间:2018-08-18 浏览次数:17314 来源:妇幼营养分会
中国营养学会妇幼营养分会
序言
乳铁蛋白(Lactoferrin, LF)是转铁蛋白家族中的一种铁结合糖蛋白,存在于人体的乳汁和各种分泌液中,以母乳中的含量最高。人和牛乳铁蛋白氨基酸序列具有69%的同源性,因此二者具有相似的生物活性。乳铁蛋白具有抗微生物、促进肠道发育、促进铁吸收、免疫调节等功能。中国营养学会妇幼营养分会按照循证医学原则,选择当前最佳证据,经反复讨论修改,最终形成乳铁蛋白婴幼儿健康效应专家共识。证据等级采用牛津循证医学中心分级系统。
1. 概述
1.1 乳铁蛋白的结构
乳铁蛋白分子质量约为80千道尔顿,人和牛乳铁蛋白分别由691和689个氨基酸组成(1),氨基酸序列具有69%的同源性 (1, 2)。人和牛乳铁蛋白的三级结构很相似,但不完全相同。每一分子乳铁蛋白包含两个同源的叶,称为N叶和C叶,分别指分子的N端和C端。每一叶片又由两个子叶或结构域组成,形成一个裂缝,三价铁离子协同一个(重)碳酸盐阴离子紧密结合在这个裂缝中,这些结构域分别称为N1,N2,C1和C2 (1)。
1.2 母乳中乳铁蛋白的含量
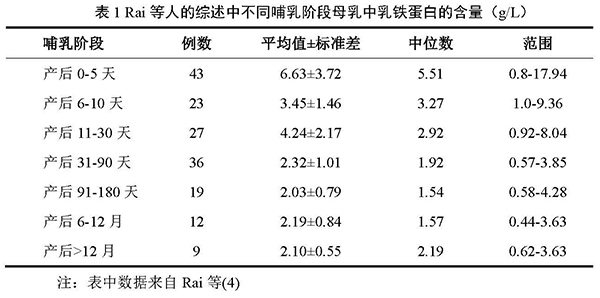
乳铁蛋白存在于人体的乳汁和各种分泌液中,在母乳中含量最高(3)。Rai等(4)2014年发表的一篇有关母乳乳铁蛋白含量的系统综述中,分析了1966-2010年间相关的94篇文献后,将其中符合要求的52篇文献进行了整理统计(包括2724名研究者),主要研究对象来自欧洲,部分来自非洲和南美洲。分析结果显示,在早期母乳中(<28天),乳铁蛋白的平均水平为4.91±0.31g/L (±SEM),范围0.34 – 17.94 g/L;在成熟母乳((≥28天)中,乳铁蛋白的平均水平为2.10±0.87g/L,范围0.44–4.4g/L。以不同哺乳阶段进行分组,所得出平均乳铁蛋白含量如表1所示。
1.3加工工艺对乳铁蛋白活性的影响
乳铁蛋白在加热时会发生不同程度的变性,变性程度主要与加热时间、pH值和铁饱和度等有关(5, 6),巴氏消毒以及冷冻储存等手段都会在一定程度上降低乳铁蛋白的含量和活性(7)。同样,在乳制品加工过程中,如脱脂乳、乳清以及乳蛋白的分离过程中,由于受到高压处理,其中的乳铁蛋白也会大量发生变性(8)。因此,在加工乳制品中,如果没有经过额外特别添加,原本较低的乳铁蛋白水平会进一步降低。
目前,已有商品化的高活性的牛乳来源的乳铁蛋白添加到加工乳制品中以提高活性乳铁蛋白含量。为了更好的保持乳铁蛋白活性,对牛乳来源的乳铁蛋白的提纯主要是在巴氏消毒之后,采用离子交换层析、超滤、微孔过滤、干燥或者冷冻干燥的技术加以提纯。Lönnerdal 等通过体外细胞研究发现,通过提纯工艺得到的乳铁蛋白,在刺激肠道上皮细胞增殖和分化方面具有与人乳铁蛋白相似的生物活性。体外消化模拟实验也显示,与人乳铁蛋白一样,牛乳提取的乳铁蛋白也可以部分抵抗消化作用,并能够结合额外的铁(9)。
2. 乳铁蛋白与婴幼儿、儿童、孕妇健康效应的研究证据
鉴于目前有关乳铁蛋白人群健康效应的人群研究文献采用的干预物均是牛乳来源的乳铁蛋白,本共识中列出的证据采用的干预物质均为牛乳铁蛋白(Bovine Lactoferrin, BLF)。
2.1 乳铁蛋白降低婴幼儿、儿童腹泻发病率的研究证据
Ochoa等(10)在秘鲁开展了一项针对555名12~18月龄健康婴幼儿的双盲、随机对照试验,评估乳铁蛋白对婴幼儿腹泻的影响。试验组277例,每天添加两次牛乳铁蛋白,每次0.5g;安慰剂组(安慰剂为麦芽糖糊精)278例,观察6个月。结果发现,试验组和安慰剂组腹泻发病率分别为6.6%和7.0%,腹泻持续时间分别为4.76天 和5.34天,中重度脱水发生率分别为1.0% 和2.6%,试验组均显著低于安慰剂组(证据级别1b)。
Chen等(11) 在中国开展的随机对照试验,将260名仅进行过母乳喂养且已断奶的4-6月龄婴儿,随机分到乳铁蛋白强化配方奶组和对照组,每组130例,分别给予牛乳铁蛋白含量为38 mg/ 100 g的强化配方奶和不含牛乳铁蛋白的配方奶,两组配方奶中铁含量均为4 mg/100 g,干预三个月,同时设置仅进行母乳喂养的母乳喂养组(n=130)。结果显示,乳铁蛋白强化配方奶组和母乳喂养组婴儿呕吐、恶心、疝气以及腹泻相关疾病发生率显著低于对照组(P<0.05)(证据级别1b)。
日本学者Egashira 等(12) 对234名5岁以下、对牛奶不过敏的健康婴幼儿的非随机对照试验也获得类似结果,每日添加100mg牛乳铁蛋白可降低总的腹泻和呕吐的发病率,缩短腹泻和呕吐的持续时间,但对轮状病毒引起的腹泻没有影响,提示乳铁蛋白对腹泻发生具有预防效应(证据级别2b)。但上述几项研究所用乳铁蛋白剂量差异较大。
2.2乳铁蛋白降低新生儿坏死性小肠结肠炎的研究证据
Manzoni等2014年(13)开展了包括意大利和新西兰的13个新生儿重症监护室的多中心随机对照试验,观察补充乳铁蛋白对新生儿坏死性小肠结肠炎的健康效应。743名极低出生体重儿被随机分为3组,牛乳铁蛋白组(口服牛乳铁蛋白100mg/d,247例)、牛乳铁蛋白联合鼠李糖乳杆菌组(238例)和安慰剂组(258例),观察至出生后30天,出生体重< l000g的则口服至出生后45天。结果发现,牛乳铁蛋白组坏死性小肠结肠炎发病率为2.0%,牛乳铁蛋白联合鼠李糖乳杆菌组为0.0%,均显著低于安慰剂组的5.4%。两个试验组新生儿总死亡率和坏死性小肠结肠炎的死亡率也显著低于安慰剂组(证据级别1b)。
在意大利开展的一项包括472名极低出生体重儿的双盲随机对照试验(14)也得出相似的结论,每日给予100mg的牛乳铁蛋白可降低极低出生体重儿坏死性小肠结肠炎的发病率和死亡率(证据级别1b)。
Akin等(15)在土耳其开展的双盲、随机、安慰剂对照研究,共纳入47例出生体重<1500 g和/或出生胎龄<32周的新生儿。干预组(22例)给予牛乳铁蛋白200 mg/d,对照组(25例)给予生理盐水2 mL。从新生儿喂养量达到20 mL/kg/d开始,牛乳铁蛋白或生理盐水溶于母乳、配方中,干预至出院或死亡。结果显示,干预组未发生坏死性小肠结肠炎,对照组发生5例小肠结肠炎(2例III期,3例II期)。干预期间未发生与牛乳铁蛋白相关的不良事件(证据级别1b)。
2.3乳铁蛋白提高儿童幽门螺杆菌根除率的研究证据
2014年,王艳丽等(16)对3~15岁儿童进行随机对照试验,观察乳铁蛋白联合幽门螺杆菌标准三联疗法对幽门螺杆菌感染根除率的影响及其不良反应。试验组患儿(n=45)接受标准三联疗法同时给予牛乳铁蛋白胶囊(每粒胶囊含牛乳铁蛋白25 mg),每次2粒,早晚各1次;对照组患儿(n=45)接受标准三联疗法治疗。结果显示,试验组患儿幽门螺杆菌根除率为91.11% (41/45),高于对照组(73.33%);试验组不良反应率(4.44%, 2/45)低于对照组(20.00%, 9/45),差异均有统计学意义(P<0.05)。提示乳铁蛋白能提高标准药物治疗方法的幽门螺杆菌根除率,减少不良反应的发生(证据级别1b)。
2.4 乳铁蛋白降低婴幼儿、儿童呼吸道疾病的研究证据
King等(17)在美国开展的双盲随机对照试验,将52名34周胎龄~生后4周、健康的配方奶粉喂养儿随机分到试验组和对照组,每组各26例,分别摄入含850mg/L和含102mg/L牛乳铁蛋白的配方奶粉,观察一年。结果发现,试验组和对照组下呼吸道感染的发作频率分别为0.15次/年和0.50次/年,试验组显著低于对照组(P<0.05)(证据级别1b)。上文中提到的Chen等(11) 在中国开展的随机对照试验也显示,乳铁蛋白强化配方奶组和母乳喂养组婴儿呼吸道相关疾病、流鼻涕、咳嗽、喘息症状发生率显著低于不含牛乳铁蛋白的配方奶的对照组(P<0.05)(证据级别1b)。
中国江苏的一项包括98例年龄在11个月-13岁的反复呼吸道感染患儿的随机对照试验也获得类似的结果(18),在常规治疗基础上给予50-100mg/d的乳铁蛋白胶囊治疗,可提高患儿治疗的总有效率(证据级别1b)。
2.5乳铁蛋白降低新生儿败血症的研究证据
Manzoni等(14)在意大利11个3级新生儿重症监护病房进行多中心双盲随机对照试验,探讨牛乳铁蛋白对极低出生体重儿败血症发病率的影响。472例极低出生体重儿随机分为3组:口服100mg/d牛乳铁蛋白组153例、牛乳铁蛋白联合6×109CFU/d鼠李糖乳杆菌组151例和安慰剂组168例,出生体重< l500g的口服至生后30天,出生体重<l000g的口服至生后45天。结果发现,牛乳铁蛋白组和牛乳铁蛋白联合鼠李糖乳杆菌组晚发型败血症的发病率分别为5.9%和4.6%,均显著低于安慰剂组的17.3% (P<0.001),2个试验组与安慰剂组相比,其晚发型败血症发病风险分别降低66%(相对危险度为0.34,95% CI为0.17-0.70)和73% (相对危险度为0.27,95% CI为0.12-0.60),对出生体重<l000g的新生儿效果更显著。牛乳铁蛋白组和牛乳铁蛋白联合鼠李糖乳杆菌组的新生儿败血症死亡率分别为0%和0.7%,均显著低于安慰剂组的4.8%(证据级别1b)。
Kaur等(19) 在印度进行的双盲随机对照试验,评估牛乳铁蛋白对低出生体重新生儿(出生体重<2000 g)迟发型败血症首次发病的预防作用。新生儿随机分到乳铁蛋白组和对照组,乳铁蛋白组63例,在第1-28天龄内口服乳铁蛋白(100 mg牛乳铁蛋白+100 mg葡萄糖),对照组67例,给予安慰剂(100 mg葡萄糖)。结果发现,经血培养证实的首发迟发型败血症发生率乳铁蛋白组低于对照组(3.2% vs. 13.4%, P=0.036)。乳铁蛋白组无败血症相关死亡,对照组败血症相关死亡率为7.5% (P=0.027)。另外,乳铁蛋白组与对照组相比,脑膜炎、血小板减少症、凝血异常、喂养不耐受等发生率均显著减少(证据级别1b)。
Ochoa等(20)在秘鲁开展的包括190名体重<2500g新生儿的双盲、随机、安慰剂对照试验,其中80例(42.1%)出生体重<1500 g。干预组(95例)给予口服牛乳铁蛋白200 mg/kg/d,每天三次,对照组给予麦芽糊精,从婴儿能开始经肠道喂养开始,持续至28天。结果显示,累计的败血症发生率,干预组低于对照组(12.6% vs. 22.1%);在极低出生体重儿(<1500 g)中,败血症发生率干预组低于对照组(20.0% vs. 37.5%)。干预期间,只发生3次与干预相关的呕吐,99.7%的观察期内没有过敏或不耐受表现(证据级别1b)。
Akin等(15)在土耳其开展的双盲、随机、安慰剂对照研究,纳入47例出生体重<1500 g和/或出生胎龄<32周的新生儿。干预组(n=22)给予牛乳铁蛋白200 mg/d,对照组(n=25)给予生理盐水2 mL。从新生儿喂养量达到20 mL/kg/d开始,牛乳铁蛋白或生理盐水溶于母乳、配方中,干预至出院或死亡。结果显示,干预组中4例发生4次医源性败血症,对照组中8例发生14次医源性败血症,每千天患病日医源性败血症发生数(number of sepsis attacks per 1,000 patient days)干预组和对照组分别为4.4/1000和17.3/1000,差异有统计学意义(P=0.007)(证据级别1b)。
2.6 乳铁蛋白改善婴幼儿贫血、促进其生长发育的研究证据
King等(17)对52名34周胎龄~生后4周婴儿的随机对照试验发现,摄入含850mg/L乳铁蛋白的强化配方奶粉婴儿的红细胞压积(37.1%)显著高于摄入含102mg/L乳铁蛋白的强化配方奶粉组的婴儿(35.4%,P<0.05),在前6个月的试验期中,摄入含850mg/L乳铁蛋白的强化配方奶粉组与摄入含102mg/L乳铁蛋白的强化配方奶粉组相比,婴儿增重的趋势更为显著(证据级别1b)。
Ke 等(21)在中国四川对213名4-6月龄的健康足月儿的随机对照试验显示,同时给予添加38mg/ 100g牛乳铁蛋白和4mg/100g铁元素配方奶的婴儿的体重、年龄体重Z评分、身高体重Z评分、血清铁、血清转铁蛋白受体和体内总铁含量均显著高于仅给予4mg/100g铁元素配方奶的婴儿(证据级别1b)。
陈冠仪等(22)进行的干预试验,按照自愿的原则将新生儿分为母乳喂养组(n=32)和配方奶喂养组,配方奶喂养组再随机分为含乳铁蛋白配方奶组(38 mg/100 g, n=32)和不含乳铁蛋白配方奶组(n=32),从刚出生喂养至6月龄大,并随访至6月龄。结果显示,6月龄时,乳铁蛋白配方奶喂养组婴儿的头围、体重与母乳喂养组接近,但高于不含乳铁蛋白配方奶组(P<0.05),三组婴儿身长比较无差异。乳铁蛋白配方奶喂养组血红蛋白浓度与不含乳铁蛋白配方奶喂养组无差异(P> 0.05),但高于母乳喂养组(P<0.05);乳铁蛋白配方奶组红细胞压积、红细胞平均体积以及网织红细胞计数均显著高于不含乳铁蛋白配方奶组和母乳喂养组(P<0.05);两组婴儿丹佛发育筛查测试评估无差异(证据级别2b)。
Hernell等(23)将59名2周~6月龄的健康足月儿,按其父母意愿分到母乳喂养组(n=16例)和配方奶粉组,其中配方奶粉组随机分为强化硫酸亚铁1组(n=12例,添加1.6mg Fe/L)、强化硫酸亚铁2组(n=11例,添加4mg Fe /L)、硫酸亚铁+乳铁蛋白组(n=10例,添加1.8mg Fe/L,其中1.3mg的铁来自结合铁的牛乳铁蛋白)和硫酸亚铁+核苷酸组(n=10例,添加2.2mg/L铁和40mg/L核苷酸)。分别于婴儿1、4和6月龄时测量其身高、体重、血红蛋白、血清铁和总铁含量。结果显示,与母乳喂养组相比,硫酸亚铁+乳铁蛋白组婴儿身高、体重和营养状况无统计学差异,但硫酸亚铁+乳铁蛋白组婴儿在4月龄和6月龄时的身高(64.7±2.3cm和68.3±2.5cm)显著高于硫酸亚铁+核苷酸组的婴儿(61.6±2.3cm和66.5±2.4cm) (P<0.05);硫酸亚铁+乳铁蛋白组婴儿的体重(8524±1315g)在6月龄时亦显著高于硫酸亚铁+核苷酸组(7461±823g);但在婴幼儿铁营养方面,如血红蛋白、血清铁和总铁含量上,各组间无显著差异(证据级别2b)。
刘瑛等(24)对非母乳喂养晚期早产儿(出生胎龄34~36周)进行随机对照试验,研究乳铁蛋白对晚期早产儿贫血及神经行为发育的影响。从研究对象1月龄起,铁剂治疗组(n=60)给予口服硫酸亚铁口服液(2~4 mg/kg/d),乳铁蛋白组(n=60)给予口服乳铁蛋白胶囊(25 mg/粒/天),干预并随访到6月龄。结果发现,两组出生时及6月龄时的身长、体重、头围无显著差异;两组干预前及干预后的血红蛋白、红细胞压积、网织红细胞、血清铁蛋白差异均无统计学意义(P>0.05);两组6月龄时Gesell评估各能区发育商无统计学差异(P>0.05),表明乳铁蛋白对预防晚期早产儿贫血与铁剂补充有类似效果(证据级别1b)。
2.7 乳铁蛋白改善孕妇贫血的研究证据
Nappi等(25)采用双盲随机对照试验,观察补充乳铁蛋白对孕妇缺铁性贫血的治疗效果。乳铁蛋白组49例,每天口服100mg乳铁蛋白两次,对照组48例,每天口服520mg硫酸亚铁一次,干预30天。结果发现,乳铁蛋白组和对照组孕妇血清血红蛋白、铁蛋白和铁浓度与治疗前相比均显著增加,同时铁结合能力下降,但两组无显著差异,且乳铁蛋白组不良反应(如恶性、呕吐、腹痛等)发生率显著低于对照组,提示乳铁蛋白对缺铁性贫血的治疗效果与硫酸亚铁相似但有更少的胃肠道不良反应(证据级别1b)。
Paesano等(26)进行的随机对照试验,观察与口服硫酸亚铁相比,牛乳铁蛋白对具有血栓形成倾向孕妇的安全性和有效性。牛乳铁蛋白组孕妇(n=156)每天口服100mg牛乳铁蛋白两次,硫酸亚铁组(n=139)每天口服520mg硫酸亚铁一次。结果显示,牛乳铁蛋白组孕妇的血清红细胞、血红蛋白、总血清铁高于硫酸亚铁组(P<0.0001),而血清白介素-6显著低于硫酸亚铁组,牛乳铁蛋白组未出现副作用,而硫酸亚铁组有5名孕妇流产,23名出现副作用(证据级别1b)。
3. 乳铁蛋白发挥其健康效应的生物学机制
乳铁蛋白通过抗微生物、促进肠道发育、促进铁吸收、免疫调节等来发挥其健康效应。乳铁蛋白具有结合铁离子的能力,在病原体周围形成一个缺铁的环境,减少微生物对铁这种必需元素的吸收,从而抑制微生物的生长。体外和动物研究发现,乳铁蛋白对多种革兰氏阳性和革兰氏阴性致病菌呈现抑菌活性(27),并具有抑制诺瓦克病毒复制(28)和抑制念珠菌增殖的功能(29)。
乳铁蛋白具有促进肠道发育的功能。体外研究发现,不同浓度乳铁蛋白处理的肠上皮细胞计数均显著增加 (30)。用乳铁蛋白喂养新生小猪后,小猪十二指肠中脑源性神经营养因子和泛素羧基末端水解酶的mRNA表达水平均显著增加,空肠腺窝大小、宽度和深度,十二指肠绒毛面积、长度和宽度均增加,生长速度加快(31)。此外,乳铁蛋白能促进胃肠道中的有益菌如双歧杆菌、乳酸菌的增殖,同时保护肠道不被有害细菌损伤,改善肠道微生物菌群,维持肠道菌群的平衡(32)。
乳铁蛋白能通过肠细胞表面的乳铁蛋白受体介导的内吞作用促进铁吸收,摄入铁饱和乳铁蛋白能显著增加体内红细胞密度和血红蛋白浓度(33, 34)。
4. 小结
乳铁蛋白是母乳中重要的活性蛋白。现有的人群研究结果显示,乳铁蛋白可预防和辅助治疗婴幼儿腹泻、新生儿坏死性小肠结肠炎、呼吸道疾病、新生儿败血症,对改善婴幼儿贫血和促进其生长发育也有一定的作用。但共识中提到的各项研究所用的乳铁蛋白的剂量不同,且相差较大,给予方式也有不同,有些是口服乳铁蛋白,有些是通过乳制品获得。因此,对于乳铁蛋白的临床应用,临床医生需结合婴幼儿的临床症状和体征等实际情况,给予正确使用。
起草专家:苏宜香、汪之顼、张彩霞、赖建强、盛晓阳、曾果、杨年红、衣明纪
评审专家:邵洁、陈平洋、滕越、胡燕、李光辉、李燕、毛丽梅、童笑梅、徐秀、徐轶群、张琚
秘书:丁叶
参考文献
1. Steijns JM, van Hooijdonk AC. Occurrence, structure, biochemical properties and technological characteristics of lactoferrin. Br J Nutr. 2000;84 (Suppl 1):S11-7.
2. Pierce A, Colavizza D, Benaissa M, Maes P, Tartar A, Montreuil J, et al. Molecular cloning and sequence analysis of bovine lactotransferrin. Eur J Biochem. 1991;196(1):177-84.
3. Lönnerdal B, Iyer S. Lactoferrin: molecular structure and biological function. Annu Rev Nutr. 1995; 15:93-110.
4. Rai D, Adelman AS, Zhuang W, Rai GP, Boettcher J, Lönnerdal B. Longitudinal changes in lactoferrin concentrations in human milk: a global systematic review. Crit Rev Food Sci Nutr. 2014;54(12):1539-47.
5. EFSA Panel on Dietetic Products (2012a). Scientific Opinion on bovine lactoferrin. EFSA Journal. 2012; 10(5):2701.
6. Kussendrager K. Effects of heat treatment on structure and iron-binding capacity of bovine lactoferrin. IDF Bulletin: Indigenous Antimicrobial Agents of Milk: Recent Developments1994.
7. Akinbi H, Meinzen-Derr J, Auer C, Ma Y, Pullum D, Kusano R, et al. Alterations in the host defense properties of human milk following prolonged storage or pasteurization. J Pediatr Gastroenterol Nutr. 2010; 51(3):347-52.
8. Mazri C, Sánchez L, Ramos SJ, Calvo M, Pérez MD. Effect of high-pressure treatment on denaturation of bovine lactoferrin and lactoperoxidase. J Dairy Sci. 2012; 95(2):549-57.
9. Lönnerdal B, Jiang R, Du X. Bovine lactoferrin can be taken up by the human intestinal lactoferrin receptor and exert bioactivities. J Pediatr Gastroenterol Nutr. 2011; 53(6):606-14.
10. Ochoa TJ, Chea-Woo E, Baiocchi N, Pecho I, Campos M, Prada A. Randomized double-blind controlled trial of bovine lactoferrin for prevention of diarrhea in children. J Pediatr. 2013; 162(2):349-56.
11. Chen K, Chai L, Li H, Zhang Y, Xie HM, Shang J, et al. Effect of bovine lactoferrin from iron-fortified formulas on diarrhea and respiratory tract infections of weaned infants in a randomized controlled trial. Nutrition. 2016; 32(2):222-7.
12. Egashira M, Takayanagi T, Moriuchi M, Moriuchi H. Does daily intake of bovine lactoferrin-containing products ameliorate rotaviral gastroenteritis? Acta Paediatr. 2007; 96(8):1242-4.
13. Manzoni P, Meyer M, Stolfi I, Rinaldi M, Cattani S, Pugni L. Bovine lactoferrin supplementation for prevention of necrotizing enterocolitis in very-low-birth-weight neonates: a randomized clinical trial. Early Hum Dev. 2014; 90 (Suppl 1):S60-5.
14. Manzoni P, Rinaldi M, Cattani S, Pugni L, Romeo MG, Messner H, et al. Bovine lactoferrin supplementation for prevention of late-onset sepsis in very low-birth-weight neonates: a randomized trial. JAMA. 2009; 302(13):1421-8.
15. Akin IM, Atasay B, Dogu F, Okulu E, Arsan S, Karatas HD, et al. Oral lactoferrin to prevent nosocomial sepsis and necrotizing enterocolitis of premature neonates and effect on T-regulatory cells. Am J Perinatol. 2014; 31(12):1111-20.
16. 王艳丽, 李春力, 庄探月, 程艳波. 乳铁蛋白联合标准疗法治疗儿童幽门螺杆菌感染的疗效. 临床儿科杂志. 2014; 32(4):309-11.
17. King JC J, Cummings GE, Guo N, Trivedi L, Readmond BX, Keane V, et al. A double-blind, placebo-controlled, pilot study of bovine lactoferrin supplementation in bottle-fed infants. J Pediatr Gastroenterol Nutr. 2007;44(2):245-51.
18. 潘伟, 罗靖, 徐进生, 贲晓明. 乳铁蛋白治疗反复呼吸道感染患儿的疗效. 实用儿科临床杂志. 2007;22(22):1713-4.
19. Kaur G, Gathwala G. Efficacy of bovine lactoferrin supplementation in preventing late-onset sepsis in low birth weight neonates: a randomized llacebo-controlled clinical trial. J Trop Pediatr. 2015; 61(5):370-6.
20. Ochoa TJ, Zegarra J, Cam L, Llanos R, Pezo A, Cruz K, et al. Randomized controlled trial of lactoferrin for prevention of sepsis in peruvian neonates less than 2500 g. Pediatr Infect Dis J. 2015; 34(6):571-6.
21. Ke C, Lan Z, Hua L, Ying Z, Humina X, Jia S, et al. Iron metabolism in infants: influence of bovine lactoferrin from iron-fortified formula. Nutrition. 2015; 31(2):304-9.
22. 陈冠仪, 陈同辛, 陈惠金, 何振娟, 吴圣楣. 含乳铁蛋白配方奶喂养对婴儿生长发育和外周血细胞数值的影响. 中国医师进修杂志. 2011; 34(15):52-4.
23. Hernell O, Lönnerdal B. Iron status of infants fed low-iron formula: no effect of added bovine lactoferrin or nucleotides. Am J Clin Nutr. 2002; 76(4):858-64.
24. 刘瑛, 王馨, 林少勇, 吴婕翎, 柯海劲. 乳铁蛋白对晚期早产儿贫血及神经行为发育的影响. 中国处方药. 2014; 12(8):6-8.
25. Nappi C, Tommaselli GA, Morra I, Massaro M, Formisano C, Di Carlo C. Efficacy and tolerability of oral bovine lactoferrin compared to ferrous sulfate in pregnant women with iron deficiency anemia: a prospective controlled randomized study. Acta Obstet Gynecol Scand. 2009; 88(9):1031-5.
26. Paesano R, Pacifici E, Benedetti S, Berlutti F, Frioni A, Polimeni A, et al. Safety and efficacy of lactoferrin versus ferrous sulphate in curing iron deficiency and iron deficiency anaemia in hereditary thrombophilia pregnant women: an interventional study. Biometals. 2014; 27(5):999-1006.
27. Jahani S, Shakiba A, Jahani L. The antimicrobial effect of lactoferrin on Gram-Negative and Gram-Positive bacteria. Int J Infect. 2015; 2(3):e27954.
28. Ishikawa H, Awano N, Fukui T, Sasaki H, Kyuwa S. The protective effects of lactoferrin against murine norovirus infection through inhibition of both viral attachment and replication. Biochem Biophys Res Commun. 2013; 434(4):791-6.
29. Velliyagounder K, Alsaedi W, Alabdulmohsen W, Markowitz K, Fine DH. Oral lactoferrin protects against experimental candidiasis in mice. J Appl Microbiol. 2015; 118(1):212-21.
30. Buccigrossi V, de Marco G, Bruzzese E, Ombrato L, Bracale I, Polito G, et al. Lactoferrin induces concentration-dependent functional modulation of intestinal proliferation and differentiation. Pediatr Res. 2007; 61(4):410-4.
31. Yang C, Zhu X, Liu N, Chen Y, Gan H, Troy FA, et al. Lactoferrin up-regulates intestinal gene expression of brain-derived neurotrophic factors BDNF, UCHL1 and alkaline phosphatase activity to alleviate early weaning diarrhea in postnatal piglets. J Nutr Biochem. 2014; 25(8):834-42.
32. Hu W, Zhao J, Wang J, Yu T, Wang J, Li N. Transgenic milk containing recombinant human lactoferrin modulates the intestinal flora in piglets. Biochem Cell Biol. 2012; 90(3):485-96.
33. Gíslason J, Douglas GC, Hutchens TW, Lönnerdal B. Receptor-mediated binding of milk lactoferrin to nursing piglet enterocytes: a model for studies on absorption of lactoferrin-bound iron. J Pediatr Gastroenterol Nutr. 1995; 21(1):37-43.
34. Kawakami H, Hiratsuka M, Dosako S. Effects of iron-saturated lactoferrin on iron absorption. Agric BioI Chem. 1988; 52(4):903-8.

 京公网安备 11010502053192号
京公网安备 11010502053192号